Вакцины для блокирования COVID-19 которые разрабатываются Moderna, Pfizer, AstraZeneca и другими и которые в настоящее время проходят фазу III клинических испытаний, могут не так хорошо охватить людей с черным или азиатским генетическим По данным исследования, опубликованного в среду Массачусетским технологическим институтом, родословной, как и у белых людей.
«Очевидно, что необходимо учитывать множество других факторов, но наши предварительные результаты показывают, что в среднем люди чернокожего или азиатского происхождения могут иметь несколько повышенный риск неэффективности вакцины», — сказал один из авторов отчета Дэвид К. Гиффорд, сотрудник Лаборатории компьютерных наук и искусственного интеллекта Массачусетского технологического института (CSAIL), заявил в пресс-релизе, выпущенном MIT.
Отчет, озаглавленный «Прогнозируемые пробелы в охвате населения клеточным иммунитетом субъединичными вакцинами SARS-CoV-2 и их усиление с помощью компактных пептидных наборов», был размещен на сервере предпечатной подготовки Bioarxiv и еще не был опубликован. проверены, что означает, что к его выводам следует относиться с особой осторожностью.
Энтузиазм резко возрос в последние недели, когда Moderna, Pfizer и AstraZeneca объявили о первоначальных результатах испытаний фазы III на людях, которые показали удивительно высокий уровень иммунитета, при этом испытуемые, которым давали лекарства, были на 94–95% меньше. Вероятнее всего, чем люди, получившие плацебо, заразятся COVID-19.
Эти три вакцины — лишь самые важные из огромного множества усилий. По данным Всемирной организации здравоохранения, в настоящее время проходит клинические испытания 51 вакцина. Еще сто шестьдесят три вакцины находятся на доклинической стадии оценки.
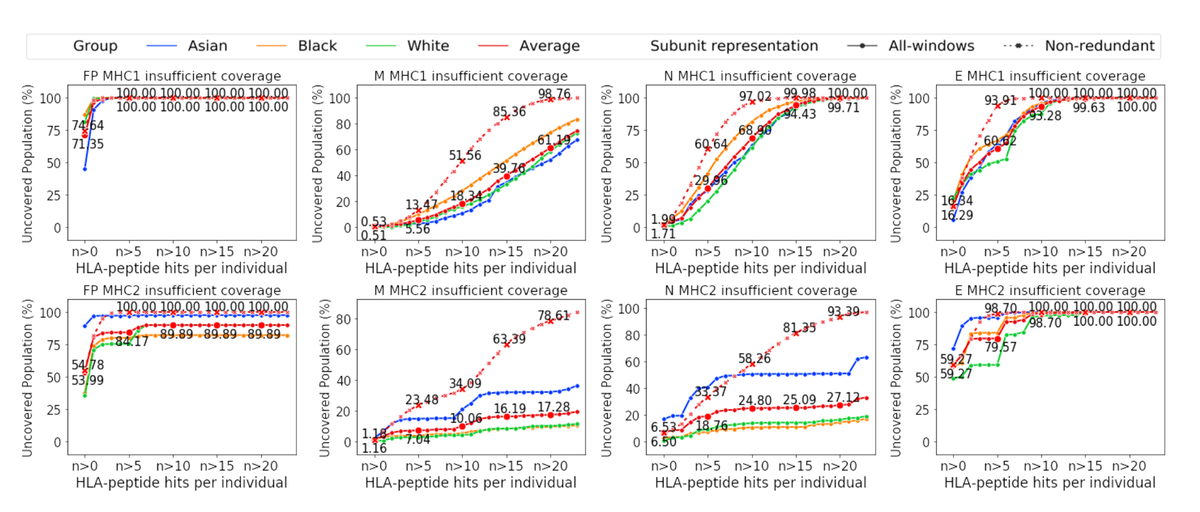
Кривые охвата показывают различный процент людей по генетическому происхождению, которые могут получить иммунный ответ на COVID-19, для различных комбинаций аллелей и комбинаций вирусных пептидов.
Лю и др.
Многие вакцины, в том числе вакцины Moderna, Pfizer и AstraZeneca, обладают одним и тем же недостатком, утверждается в отчете Массачусетского технологического института, а именно, что они не используют достаточно разнообразный набор вирусных частиц. стимулировать одинаковый уровень иммунного ответа у всех людей в популяции в зависимости от генетической структуры.
Отчет основан на компьютерных моделях in silico . Гиффорд и соавторы Ге Лю и Брэндон Картер, два аспиранта из CSAIL Массачусетского технологического института, использовали модели машинного обучения, чтобы предсказать, основываясь на данных пациентов и моделях белков в иммунной системе, насколько вероятно, что вакцины окажутся «хитом». это означает, чтобы успешно стимулировать иммунный ответ в различных группах населения на основе самооценки этнического типа или генетического происхождения.
Также: Машинное обучение Массачусетского технологического института разработало вакцину от COVID-19, которая могла бы охватить гораздо больше людей
Работа в статье основывается на работе, проделанной этим летом группой по разработке двух компьютерных моделей, которые прогнозируют охват вакцинацией. Один под названием OptiVax предсказывает стимуляцию иммунного ответа вакциной. Второй, названный EvalVax, отображает этот иммунный ответ на биохимию групп населения по этническому или генетическому наследственному статусу.
Механизм вакцины моделируется программами. Когда инвазивный организм, например вирус, попадает в организм, некоторые частицы вируса, короткие цепочки из примерно 8–25 аминокислот, известные как пептиды, входят в углубление на поверхности клеток человека. Затем клетка способна представить частицы вируса Т-клеткам тела как сигнал вторжения. Т-клетки начинают процесс уничтожения таких инфицированных клеток.
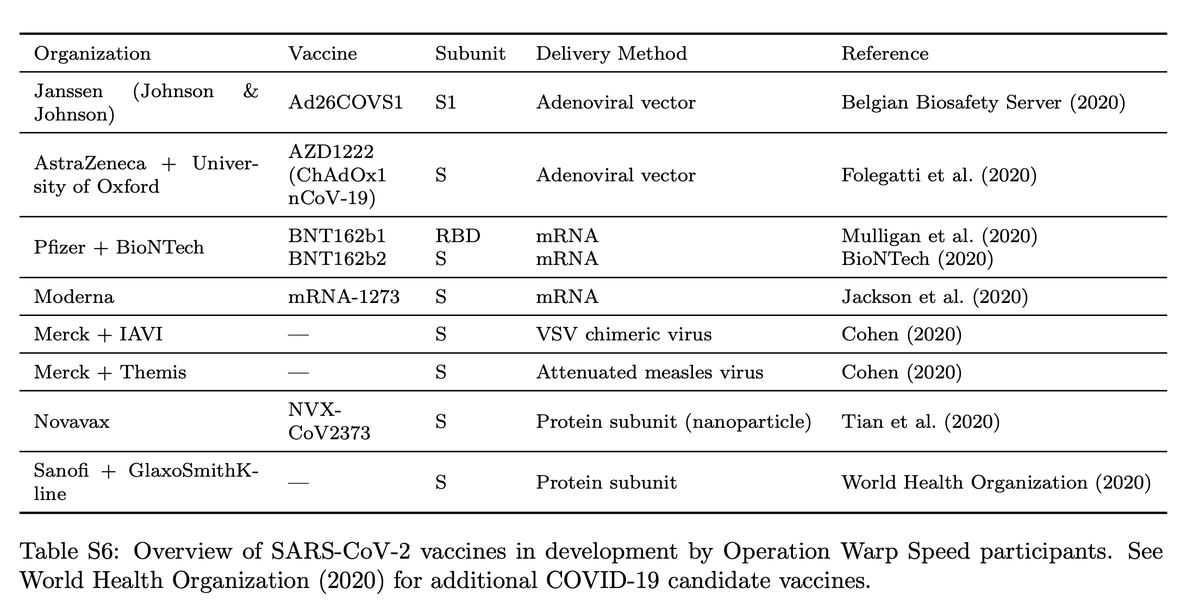
Вакцины в разработке. Гиффорд и его коллеги утверждают, что все лекарства в программе US Operation Warp Speed, в том числе от Moderna, Pfizer и AstraZeneca, имеют одну и ту же слабость, заключающуюся в том, что они группируются вокруг очень узкого набора вирусных пептидов для стимуляции иммунного ответа, что лишает их достаточное разнообразие, чтобы обеспечить самый широкий охват населения.
Лю и др.
Вот как работает естественный человеческий иммунитет, и вакцины имитируют этот процесс, используя немного вируса, специально созданного для искусственного моделирования реакции клетки.
В отчете этим летом Гиффорд и его команда предупредили, что недостаточное использование различных частей вируса может оставить пробелы в охвате. Это потому, что у людей есть разные «аллели», версии генов, в так называемом главном комплексе гистосовместимости, области человеческого генома, которая кодирует рецепторы клеточной поверхности, которые, как предполагается, соответствуют вирусным пептидам. Некоторые аллели продуцируют клеточные рецепторы, которые более или менее надежно связываются с некоторыми вирусными пептидами.
В настоящем исследовании Гиффорд и его команда основывались на этом исследовании, чтобы показать, что вакцины от Moderna, Pfizer и AstraZeneca обладают именно той слабостью, которую исследователи предсказывали при компьютерном моделировании.
Также: Глубокое обучение Массачусетского технологического института обнаружило антибиотик от микроба, который ничто другое не могло убить
Все вакцины используют те же кусочки вируса, так называемый белок Spike или S-белок, и особая область белка Spike, называемая рецепторно-связывающим доменом или RBD. «Все сообщаемые текущие усилия по разработке вакцины против COVID-19, которые являются частью правительственной операции США Warp Speed, используют варианты спайковой субъединицы SARS-CoV-2 для индукции иммунной памяти», — пишут Гиффорд и его команда.
Эта ориентация на ограниченное количество вирусных пептидов становится общей слабостью вакцин, утверждают они. «Мы обнаружили, что предлагаемые субъединичные вакцины SARS-CoV-2 демонстрируют пробелы в охвате населения в их способности генерировать надежное количество предсказанных попаданий пептида-HLA у каждого человека». HLA — это технический термин для рецепторов клеточной поверхности, которые связываются с пептидами.
Исследователи приводят несколько случаев, когда их модели показывают, что отсутствие большего пептидного разнообразия приводит к широко варьирующемуся охвату:
Основываясь на нашем прогнозе, субъединица рецепторсвязывающего домена (RBD) не имели пептидов MHC класса II, отображаемых у 15,12% популяции (в среднем по азиатским, черным и белым лицам, сообщившим о себе) […] Мы отмечаем, что выявленная популяция RBD без прогнозируемого проявления пептидов MHC класса II колеблется от 0,811 % для населения, самоотчетного как белое, до 37,287% для населения, самоотчетного как выходца из Азии.
ZDNet обратился к Moderna, Pfizer и AstrZeneca за комментариями и обновит статью любым ответом.
У авторов есть пара предложений для производителей лекарств. Один из них — явно учитывать генетическое происхождение. «Клинические испытания должны тщательно учитывать происхождение в своих исследованиях, чтобы гарантировать, что эффективность измеряется в соответствующей популяции», — пишут они.
Во-вторых, как это было сделано в de novo синтез вакцины в течение лета, Гиффорд и его сотрудники смогли настроить дизайн вакцины, чтобы включить большее разнообразие пептидов.
Их компьютерная модель дизайна лекарств предполагает, что доля людей, которые будут охвачены, значительно улучшится, если будет включено большее количество пептидов, пишут авторы:
Вычисленные наборы пептидов аугментации, по прогнозам, существенно сократят популяции, которые, по прогнозам, недостаточно покрываются каждой субъединицей. После увеличения прогнозируемая непокрытая популяция для RBD без попаданий пептидов-MHC снижается до 0,003% (MHC класс I) и 4,351% (MHC класс II) только с MIRA-положительными пептидами и 0,0% (MHC класс I) и 0,309% ( MHC class II) со всеми отфильтрованными пептидами из SARS-CoV-2. (Таблица S1).
Авторы отмечают, что их код и данные находятся в свободном доступе на GitHub.








